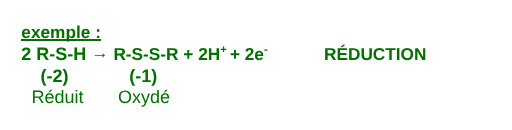Sciences analytiques
Titrages chimique : méthode sélective dont le résultat provient de molécules de propriétés voisines donc nécessité d'utiliser des méthodes spécifiques
1- Oxydo-réduction
2- Acide-base
3- Electrochimie
4- Complexométrie
Analyse spectrale : méthode spécifique dont le résultat provient exclusivement d'un seul composé, l'analyte
5- Absorption moléculaire UV-visible
6- Absorption IR
Analyse séparative :
7- Chromatographie
Réactions d'oxydo-réduction
I.Transfert d'électrons
= transfert d'électrons du réducteur (donneur) vers l'oxydant (accepteur)
-> réaction rédox se décompose en 2 ½ équations :
Propriétés :
1ère : le nombre d'électrons gagnés par l'oxydant est égal au nombre d'électrons cédés par le réducteur
= nécessité d'ajouter des ions spectateurs et des coefficients stoechiométriques pour équilibrer l'équation
2ème : quel est le sens de la réaction rédox ?
-> réactions possibles dans les 2 sens :
- dans un sens la réaction va être spontanée
= l'oxydant le + fort va être réduit = c'est lui va réagir
ex : le chlore est plus puissant que l'iode donc c'est le dichlore qui réagit
- à l'inverse, le réducteur le plus fort va être oxydé
ex : I- > Cl- ; Fe > Cu
-> I- est plus puissant que Cl- = I va réagir avec Cl-
Pour prévoir le sens de la réaction : comparer les oxydants entre eux + comparer les réducteurs entre eux
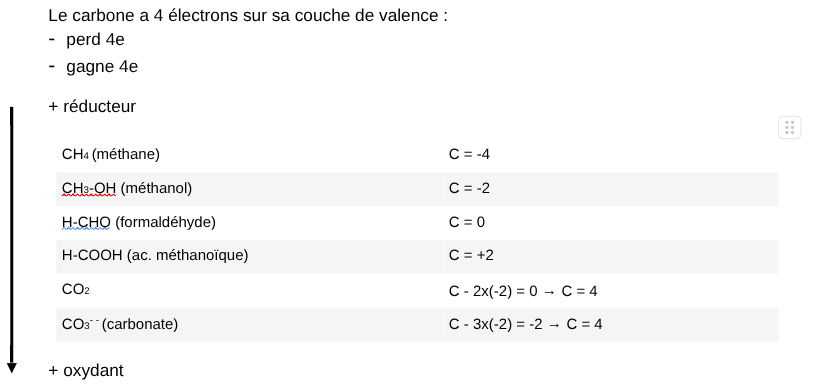
II.Degré d'oxydation (DO)
= il décrit un transfert total ou partiel d'électrons d'un atome
-> différents états d'oxydation ou de réduction
Exemple :
NaClO hypochlorite de Na : 1 - 2 + Cl = 0
-> Cl = 1 car
Na = 1
O = -2
et NaClO est neutre donc = 0
Calculs des DO :
Molécules chlorées
-> déduire le degré d’oxydation
-> déduire la compensation des charges (autant à droite/à gauche)
NaClO + (un acide) 2 H3O+ + 2e- -> NaCl + 3 H2O
+1 -1
-> le chlore a récupéré deux électrons (-)
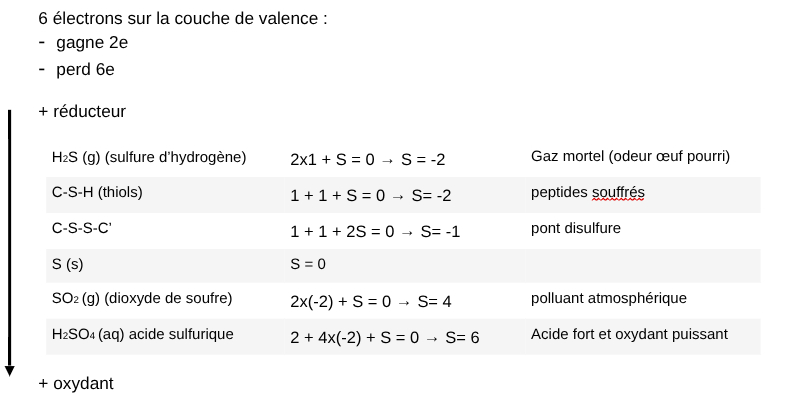
Molécules avec Soufre
III.Caractéristiques des redox
- si D.O augmente = oxydation
- si D.O diminue = réduction
-> si aucun élément ne subit de variation du DO = pas de REDOX
-> certains composés peuvent être soit oxydants, soit réducteurs
-> quand molécule diminue = elle est oxydante
-> quand molécule augmente = elle est réductrice
IV.Equilibrer des réactions rédox : coefficients de stoechiométrie
Plusieurs étapes :
- Déterminer les D.O.
- Qui est l’oxydant ? D.O. le plus élevé Qui est le réducteur ? D.O. le plus faible
- Écrire la ½ réaction d’oxydation → nombre d’électrons (perte)?
- Écrire la ½ réaction de réduction → nombre d’électrons (gains) ?
- Coefficients de stœchiométrie des demi-réactions (étape la + importante)
- Fusionner les 2 ½ réactions
- Faire intervenir (éventuellement) H+ milieu acide ou OH- alcalin pour équilibrer les charges
- Ajouter H2O
- Ajouter les ions spectateurs (ni réduit ni oxydés)