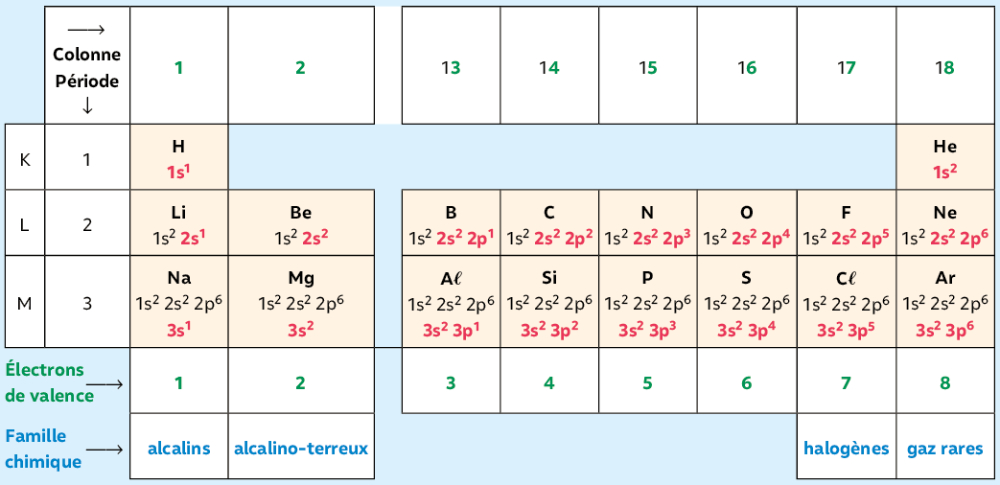
Les gaz nobles se rencontrent sous forme de gaz monoatomiques dans la nature. Ils sont situés dans la 18ème colonne du tableau périodique.
Les éléments chimiques autres que les gaz nobles sont stables dans la nature sous forme d'ions ou associés à d'autres éléments chimiques pour former des molécules.