Post-Bac
1
1
L'atome
Chimie
Définition
Atome
Formé d'un noyau central chargé positivement et d'électrons chargé négativement en mouvement autour du noyau
Numéro atomique
Nombre de protons dans le noyau, noté Z
Caractéristique de l'élément chimique
null
Nombre total de nucléons dans le noyau, noté A (par déduction, A-Z=nombre de neutrons)
Isotopes
Deux atomes de même numéro atomique mais de nombre de masse différent
Appartiennent au même élément chimique et ont les mêmes propriétés chimiques
Orbitale
Volume de l'espace où la probabilité de trouver un électron est de 95%
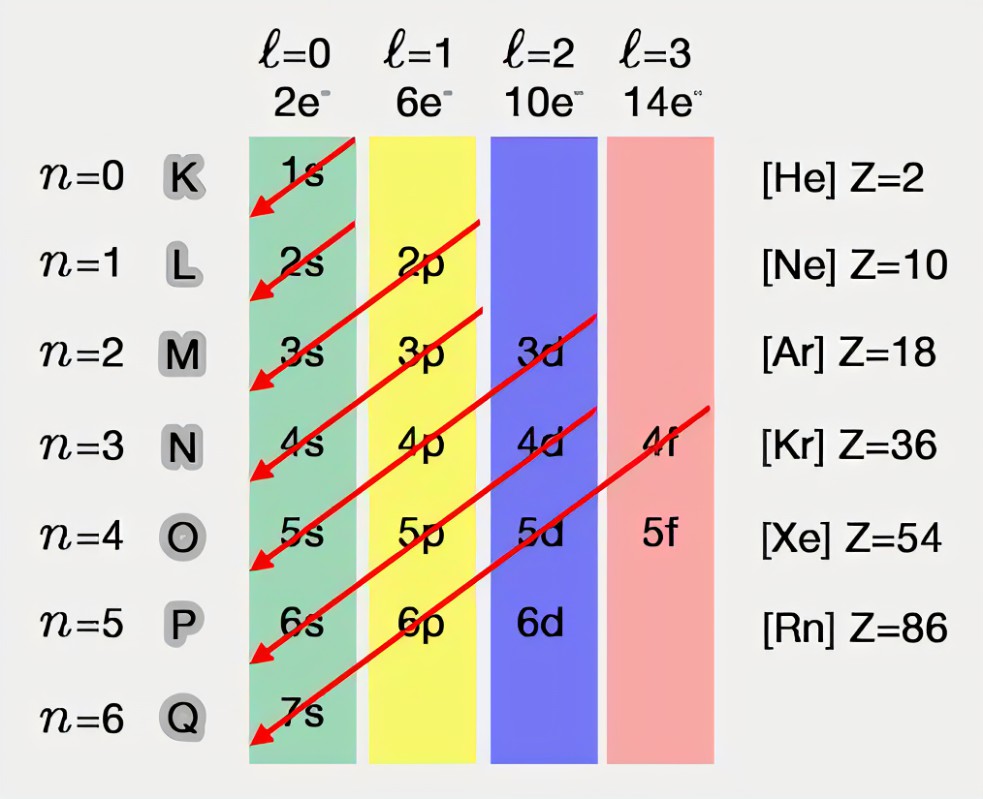
Règle de Klechkovski
Notion d'orbitale atomique :
- définie par un triplet (n, l, m) unique :
- n ? nombre quantique principal (entier strictement positif) : définie des couches (K, L, M)
- l ? nombre quantique secondaire (entier positif ou nul, strictement inférieur à n) : définie la forme de l'orbital
- m(l) ? nombre quantique magnétique (entier compris entre - l et + l) : nombre de valeur possibles donne le nombre d'orbitales de chaque type
- m(s) ? nombre de spin (vaut 1/2 ou - 1/2)
Répartition des électrons dans les orbitales :
- Règle de Pauli : deux électrons ne peuvent pas avoir leur quatre nombres quantiques identiques (les électrons diffèrent forcément par leur spin)
- Règle de Klechkovski : permet d'établir l'ordre de remplissage des différentes orbitales (1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p...)
- Règle de Hund : état le plus stables obtenu quand un maximum d'orbitales de même énergie est occupé par des électrons de spin identique
Formation d'ions monoatomiques :
- formés à partir de l'atome par perte ou gain d'un ou plusieurs électrons
Tableau périodique :
- Bloc s :
- 1° colonne : famille des alcalins (forme des cations monovalents)
- 2° colonne : famille des alcalino-terreux (forme des cations bivalents)
- Bloc p :
- colonne 13 : famille du bore
- colonne 14 : famille du carbone (forme quatre liaisons covalentes)
- colonne 15 : famille de l'azote (forme trois liaisons covalentes)
- colonne 16 : famille de l'oxygène (forme deux liaisons covalentes ou anions bivalents)
- colonne 17 : famille des halogènes (forme une liaison covalente ou anions monovalents)
- colonne 18 : famille des gaz noble ou gaz rare
- Bloc d :
- colonnes 3 à 12 : métaux de transition (forme des cations dont la sous couche d est partiellement remplie
- Bloc f :
- 2 lignes de 14 colonnes : les lanthanides et les actinides
A retenir :
Il ne faut pas dire que Z est le nombre d'électrons, ce n'est pas la définition et ce n'est vrai que pour l'atome.
Le Fluor (Z=9) est l'atome le plus électronégatif.
Post-Bac
1
1
L'atome
Chimie
Définition
Atome
Formé d'un noyau central chargé positivement et d'électrons chargé négativement en mouvement autour du noyau
Numéro atomique
Nombre de protons dans le noyau, noté Z
Caractéristique de l'élément chimique
null
Nombre total de nucléons dans le noyau, noté A (par déduction, A-Z=nombre de neutrons)
Isotopes
Deux atomes de même numéro atomique mais de nombre de masse différent
Appartiennent au même élément chimique et ont les mêmes propriétés chimiques
Orbitale
Volume de l'espace où la probabilité de trouver un électron est de 95%

Règle de Klechkovski
Notion d'orbitale atomique :
- définie par un triplet (n, l, m) unique :
- n ? nombre quantique principal (entier strictement positif) : définie des couches (K, L, M)
- l ? nombre quantique secondaire (entier positif ou nul, strictement inférieur à n) : définie la forme de l'orbital
- m(l) ? nombre quantique magnétique (entier compris entre - l et + l) : nombre de valeur possibles donne le nombre d'orbitales de chaque type
- m(s) ? nombre de spin (vaut 1/2 ou - 1/2)
Répartition des électrons dans les orbitales :
- Règle de Pauli : deux électrons ne peuvent pas avoir leur quatre nombres quantiques identiques (les électrons diffèrent forcément par leur spin)
- Règle de Klechkovski : permet d'établir l'ordre de remplissage des différentes orbitales (1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p...)
- Règle de Hund : état le plus stables obtenu quand un maximum d'orbitales de même énergie est occupé par des électrons de spin identique
Formation d'ions monoatomiques :
- formés à partir de l'atome par perte ou gain d'un ou plusieurs électrons
Tableau périodique :
- Bloc s :
- 1° colonne : famille des alcalins (forme des cations monovalents)
- 2° colonne : famille des alcalino-terreux (forme des cations bivalents)
- Bloc p :
- colonne 13 : famille du bore
- colonne 14 : famille du carbone (forme quatre liaisons covalentes)
- colonne 15 : famille de l'azote (forme trois liaisons covalentes)
- colonne 16 : famille de l'oxygène (forme deux liaisons covalentes ou anions bivalents)
- colonne 17 : famille des halogènes (forme une liaison covalente ou anions monovalents)
- colonne 18 : famille des gaz noble ou gaz rare
- Bloc d :
- colonnes 3 à 12 : métaux de transition (forme des cations dont la sous couche d est partiellement remplie
- Bloc f :
- 2 lignes de 14 colonnes : les lanthanides et les actinides
A retenir :
Il ne faut pas dire que Z est le nombre d'électrons, ce n'est pas la définition et ce n'est vrai que pour l'atome.
Le Fluor (Z=9) est l'atome le plus électronégatif.

