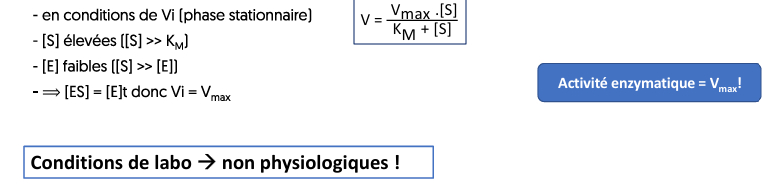La cinétique des enzymes c'est l'étude des vitesses de réactions et de leurs modifications en réponse aux changements des conditions expérimentales.
Cela permet :
- La modélisation de l'activité enzymatique
- L'étude en présence d'inhibiteurs
- La recherche des conditions optimales
Les techniques courantes pour mesurer la vitesse de la réaction
- Spectrophotométrie (ex : NADH, cf TP glucose)
- Colorimétrie (ex: Quinone, cf TP glucose)
- Fluorimétrie
- Radioctivité
- pHmétrie
Quand on mesure la vitesse de réaction, on mesure l'apparition de P, la disparition de S et l'apparition/disparition du coenzyme en fonction du temps.
Lors de la mesure :
- La phase I est quasiment linéaire
- La phase II est représenté par une inflexion de la droite par l'epuisement de S, l'inactivation de E et une grande quantité de P
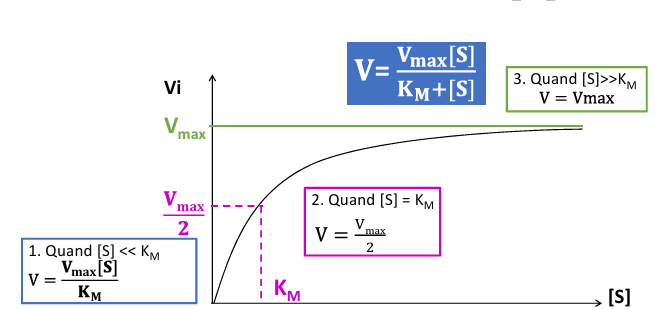
Pour comparer différents cinétiques enzymatiques, on compare les Vi (vitesse initiale)
Influence des différents paramètres de la réaction
- Les paramètres physico-chimiques : température et pH
- Les différents partenaires de la réaction : [E] et [S]
L'influence de la température à 2 effest antagonistes :
- L'effet activateur => Augmentation de l'agitation des molécules (substrat) et de la réactivité
- La thermodénaturation => Destruction des liaisons faibles (perte de la structure spatiale native)
L'influence du pH apporte des modifications de l'état d'ionisation des résidus dissociables :
- Changement de conformation de la protéine
- Modification du site catalytique (perte ou gain de liaisons H et/ou ioniques)
- Modification du nb/répartition des charges
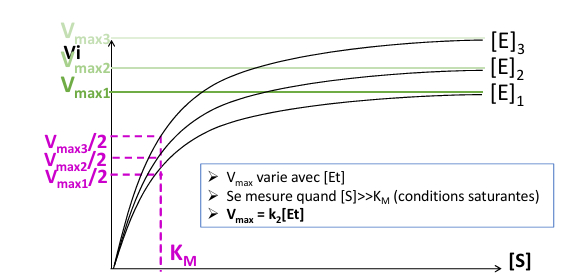
L'influence de la concentration en enzyme [E] : Graphique moodle CM3
L'influence de la concentration en enzyme [S] : Graphique moodle CM3
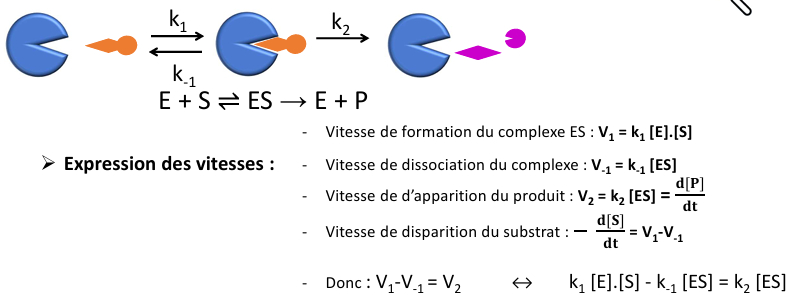
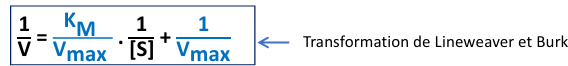
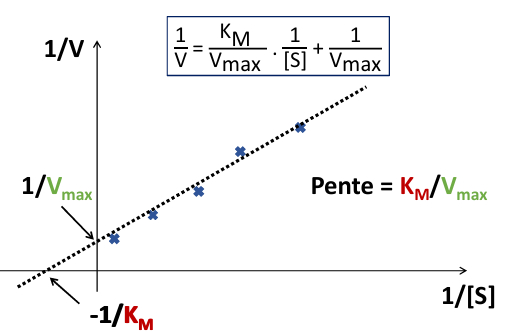
Cinétique michaelienne
Complexe enzyme-substrat