Qu'est-ce qu'une protéine ?
- Polymère d'acides aminés liés par des liaisons peptidiques et replié dans une coformation spécifique.
Origine des acides aminés
- Synthétisé par l'organisme (aa non essentiels)
- Apporté par l'alimentation (aa essentiels)
Les acides aminés essentiels sont : Met - Leu - Val - Lys - Ile - Phe - Trp - His - Thr - Arg
Structure des acides alpha-aminés
- Amine (NH2)
- Acide carboxylique (COOH)
- Chaîne latérale (R)
Stéréochimie des acides alpha-aminés
- Molécules chirales
- 2 énantiomères (molécules qui sont des images miroir non superposables l'une à l'autre)
- Acides aminés naturels => série L
Propriétés chimique
- Acido-basique : acide (COOH) ; basique (NH2)
- Ionisable en solution
- Composé amphotère (capable de se comporter à la fois comme acide et comme base)
- Si pH=7 => l'acide aminé est sous forme ionique (soluble dans l'eau)
EXERCICE TD : FORME ZWITTERION
Chez l'homme : 20 acides aminés incorporés dans les protéines (masse molaire moyenne : 110 Da)
Classement des acides aminés protéinogènes (acides aminés incorporés dans les protéines)
Les acides aminés sont classés selon leur :
- Charge
- pH
- Solubilité (polaire ou non polaire)
- Structure de la chaîne latérale (aliphatique, aromatique ...)
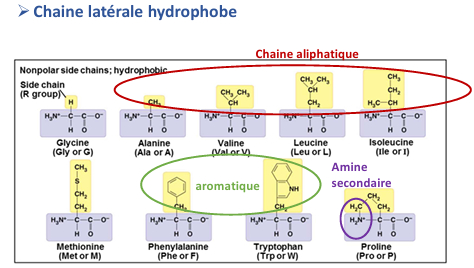
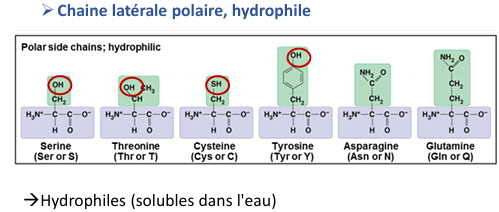
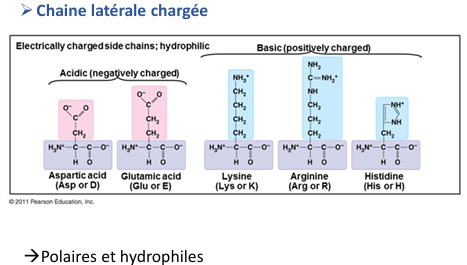
2 acides aminés protéinogènes rares
- Sélénocystéine
- Pyrrolysine
Propriétés physiques
Solubilité
- Solide : sous forme de cristaux
- Relativement soluble dans l'eau
- Faible solubilité dans les solvants
Absorption de la lumière
- Pas d'absorption dans le visible (solution incolore)
- Spectres d'absorption caractéristiques des chaînes latérales aromatiques dans l'UV moyen (détection et dosage en spectrophotométrie)
Réactivité des acides aminés
- Modification post traductionnelle des protéines (chaîne latérale)
- Utilisation pour la détection et le dosage (NH2)
- A l'origine de molécules biologiquement actives (Acide carboxylique)
Acides aminés à l'origine de molécules biologiquement actives
- Tyrosine => hormones thyroïdiennes
- Histidine => histamine
- Tryptophane => sérotine => mélatonine
- Acide glutamique => GABA
Utilisation pour la détection et le dosage
- Désamination oxydative
- Arylation (réaction de sanger)
- Carbamylation (réaction d'Edman)
Séparation des acides aminés selon :
- la charge (électrophorèse)
- la taille (chromatographie)
- la polarité (chromatographie)
L'électrophorèse
- Méthode de séparation des molécules chargées au travers d'un gel sous l'effet d'un champ électrique (la charge des acides aminés dépend du pH)
Méthode chromatographiques
- Migration de constituants à séparer sur une phase stationnaire immobile, à l'aide d'une phase mobile, liquide ou gazeuse, de nature différente
- Différentes natures de phases (couche mince, phase gazeuse, LPLC, HPLC)
- Différents types d'interactions (adsorption/affinité, échange d'ions, exclusion stérique)
Chromatographie sur couche mince
- Migration par capillarité
- Phase mobile => solvant organique (apolaire)
- Phase stationnaire => support + gel de silice (polaire)
Chromatographie d'échange d'ions
- Phase fixe : résine sur laquelle sont greffés des groupements chargés - (cations) ou + (anions)
- Elution des acides aminés fixés en faisant varier le pH




