• Représentation de Cram : permet de spécifier la géométrie d’une molécule en faisant apparaître les liaisons en perspective
Définition
1. Représentation plane

I. Représentation des molécules
• Méthode VSEPR (Valence Shell Electron Pair Repulsion) : basée sur la répulsion des paires électroniques des couches de valence.
• Formalisme utilisé : AXmEn
A : atome central
X : atomes ou groupements d’atomes liés à l’atome central
m : nombre d’atomes ou de groupements X
E : doublets non-liants portés par l’atome central
n : nombre de doublets non-liants E

La théorie de l’hybridation
déf: mélange d’orbitales de symétrie différente mais appartenant à la même couche électronique qui permet de mieux décrire qualitativement les liaisons entre atomes

Représentation en perspective cavalière
déf: tracé spécial de perspective représentant les objets sous un aspect très net, représenté d'un point de vu généralement d'en haut comme à vol d'oiseau.
Projection de Newman
déf: consiste à la projection d’une molécule dans un plan, suivant l’axe de liaison entre deux atomes de carbone défini au préalable.

Projection de Fischer
déf: représentation très utilisée dans la chimie des sucres et des acides aminés. Les conventions sont :
➢ la chaîne carbonée principale est dessinée verticalement, entièrement repliée vers l’arrière
➢ l'atome de carbone le plus oxydé est placé en haut
➢ les groupes sur l'horizontale pointent vers l'avant de la feuille
II. Nomenclature
- composés organiques
Les hydrocarbures
déf: composés uniquement càd constitués des éléments C et H
• Les hydrocarbures sont divisés en 3 classes :
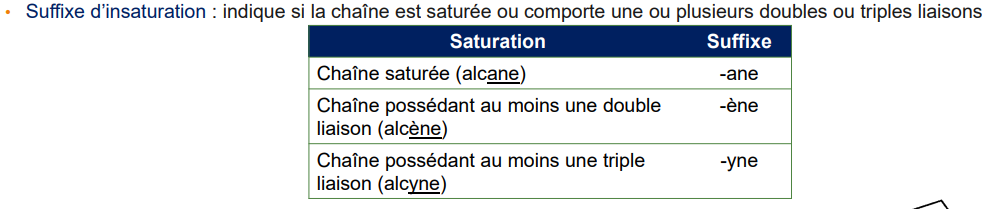
➢ les alcanes (uniquement des liaisons simples C-C)
➢ les alcènes (liaisons doubles C=C)
➢ les alcynes (liaisons triples CC)
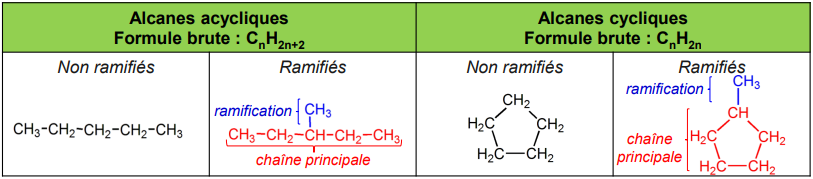
• Base de toute molécule organique : la chaîne carbonée (nom de base), celle-ci peut-être linéaire (acyclique) ou cyclique
• Il peut y avoir plusieurs chaînes, l’une est considérée comme chaîne principale et porte des ramifications (substituants)
alcane: chaîne saturée constituée uniquement de carbones sp3
Une chaîne peut être insaturée càd comporter une ou plusieurs liaisons multiples : •Liaison double : alcènes linéaires (CnH2n ), alcènes cycliques (CnH2n-2 )
• Liaison triple : alcynes (CnH2n-2 ), cycloalcynes à partir de C sup à 7 (CnH2n-4 )

• Ramification : chaîne hydrocarbonée (= substituant alkyle), plus courte que le chaîne principale, et qui est accrochée à cette dernière
• Nommer ce substituant en préfixe en précisant l’indice de position
• Nom qui dépend du nombre de C + yl
• S’il y a plusieurs fois le même groupe alkyl dans la molécule, on utilise un préfixe multiplicateur (di, tri, tétra…..)
• S’il y a plusieurs groupes substituants, ils sont placés par ordre alphabétique (sans les préfixes multiplicateurs)

• Fonction monovalente : fonction contenant un hétéroatome engagé dans une liaison avec le carbone fonctionnel (Csp3 )
• Fonction divalente : fonction contenant un hétéroatome lié par une liaison double au carbone fonctionnel
• Fonction trivalente : fonction contenant deux hétéroatomes engagés dans trois liaisons avec le carbone fonctionnel



- Composés inorganiques
a. Les composés ioniques
déf: Anion : espèce mono- ou polyatomique chargée négativement
➢ Anions monoatomiques : Ion + racine du nom de l’élément + -ure
➢ Anions monopolyatomiques + polyatomiques sans oxygène : utilisation du suffixe -ure. Pour les anions homopolyatomiques : rajouter le préfixe numérique (di-, tri-, tétra-, etc…)
➢ Anions polyatomiques possédant un ou plusieurs atomes d’oxygène : oxanions
-Suffixe -ate pour l’oxanion contenant le plus d’oxygène ou -ite pour celui ayant un atome d’oxygène en moins
-Si plus de 2 oxanions, préfixe per- rajouté au nom de l’oxanion contenant le plus d’atomes d’oxygène, préfixe hypo- rajouté à celui qui contient le moins d’atomes d’oxygène
➢Anions polyatomiques possédant un ou plusieurs atomes d’oxygène + atome(s) d’hydrogène H : faire précéder le nom de l’oxanion par le préfixe (di)hydrogéno
déf: Cation : espèce mono- ou polyatomique chargée positivement
➢ Cation monoatomique : (cat)ion + nom de l’élément métallique + degré d’oxydation si l’atome peut former deux cations différents
➢ Cations polyatomiques formés à partir de non-métaux : utilisation du suffixe -ium
• Formule chimique d’un composé ionique (sel) = cation + anion
• Nom d’un composé ionique (sel) = anion + cation
b. Les acides (de Brönsted)
• Acide : composé ionique dont le cation est H+
• L’acide contient suffisamment de H+ pour neutraliser la charge négative de l’anion
➢ Les hydracides : H+autre ion(X) = X-ure d'hydrogène / Acide X-hydrique
• Les oxacides : acides contenant un oxanion :

c. Les composés covalents binaires
• Composé covalent binaire : constitué de 2 éléments non-métalliques • Nom : (préfixe numérique) + élément « périphérique » -ure + de + atome central (Exception : Oxygène → oxyde)
III. Isomérie plane et stéréochimie
Définition
• On parle d'isomères de constitution pour des molécules dont la différence provient de l'enchaînement des atomes. On distingue :
➢ Isomérie de fonction: les isomères portent des fonctions chimiques différentes
➢ Isomérie de squelette/ isomérie de chaîne: isomères qui possèdent la même fonction chimique mais différent par leur chaîne carbonée
➢ Isomérie de position: un groupe caractéristique (fonction chimique, insaturation ou substituant) occupe une position différente sur le même squelette carboné
Définition
a. La chiralité
• déf: une molécule est dite chirale si et seulement si elle n’est pas superposable à son image dans un miroir plan
• Pour vérifier si une molécule est chirale il faut vérifier sa non-identité avec son image dans le miroir ou bien rechercher l’absence d’éléments de symétrie (centre, plan ou axe de symétrie)
b. L’énantiomérie
•déf: Deux molécules, images l’une de l’autre dans un miroir, qui ne sont pas superposables
• Propriétés des énantiomères :
➢ Propriétés physico-chimiques identiques (Tf , Teb, densité, solubilité….)
➢ Interactions différentes avec sites actifs biologiques effets biologiques différents
➢ Action différente sur la lumière polarisée
• configuration absolue R/S des carbones asymétriques
➢ Un carbone asymétrique possède 2 dispositions spatiales différentes non superposables pour ses substituants : l’une possède la configuration absolue R (rectus), l’autre S (sinister)
➢ Règles CIP :
➢ La priorité des atomes diminue avec leur numéro atomique Z
➢ Dans le cas d'isotopes, l'isotope de nombre de masse supérieur est prioritaire
➢ Si les atomes directement attachés à un centre chiral sont identiques, on compare alors les atomes de 2 ème rang (si c'est nécessaire, on considérera les atomes en 3 ème , 4 ème position...)
• Enantiomérie D/L : la nomenclature D et L est définie par rapport à la position du substituant le plus éloigné de la fonction la plus oxydée, les molécules étant représentées en projection de Fischer.
➢ en gros L ou D - nom de la molécule
➢ L ( gauche) / D ( droite )
c. La diastéréoisomérie
• déf: stéréoisomérie de configuration qui n'est pas énantiomérique (ça devient chiant la)
• Les diastéréoisomères ne sont ni superposables, ni image l'une de l'autre dans un miroir
• Propriétés physico-chimiques différentes (Tf , Teb, densité, solubilité….)
• La relation de diastéréoisomérie peut-être liée à :
➢ Présence de plusieurs centres asymétriques
➢ Disposition Z/E d’une double liaison
➢ Disposition cis/trans d’un cycle
• Diastéréoisomérie E/Z des alcènes :
➢ si les 2 groupes prioritaires sont du même côté, la liaison double est Z
➢ si les 2 groupes prioritaires sont du côté opposé, la liaison double est E
• Diastéréoisomérie cis/trans des composés cycliques : la nomenclature cis/trans est utilisée pour les composés cycliques, deux substituants sont :
➢trans s’ils ne sont pas du même côté du plan moyen du cycle
➢cis s’ils sont du même côté du plan moyen du cycle


