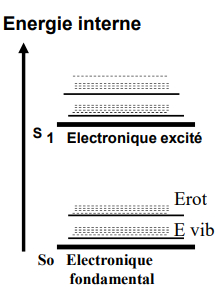
Niveaux d'énergie des molécules
énergie électronique : énergie des liaisons
- 2 niveaux électronique : S0 et S1
- sous niveaux vibrationnels
- sous niveaux rotationnels
énergie vibrationnelle : vibrations de n atomes
énergie rotationnelle : rotation autour de σ
-> énergie interne = E életrconique + E vibrationnelle + E rotationnelle
Absorption d'un photo
-> énergie électronique fondamentale (S0) + hν -> énergie électrique excité S1
- excitation :
- capture du photon S0
- -> l'orbitale moléculaire devient excitée = S1
- = transition d'énergie électronique
- desexcitation
- en 10-15 secondes, l'orbitale moléculaire perd son énergie
- -> revient à son niveau S0
-> le cycle peut recommencer : l'orbitale moléculaire peut absorber un 2ème photon
Rayonnements électromagnétiques
-> vitesse (c) : 300 000 000 m/s
-> fréquence ν (Hz)
-> longueur d'onde λ -> λ = c/ν
-> énergie -> E = hν -> E = hxc/λ
-> énergie d'un rayonnement = inversement proportionnel à λ
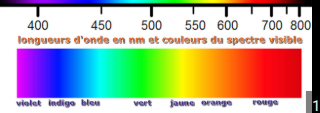
-> 200nm = en-dessous de cette valeur, l'air est opaque et ne transmet pas les UV
-> 700nm = limite du visible mais imprécis car diffère pour chaque personne
= domaine du visible restreint (400 à 700nm voir 800nm) par rapport à l'étendue de ces ondes électromagnétiques
Types d'UV :
- UV lointain : 50-200 nm = l'air et le quartz ne sont pas transparents pour ses UV lointains = opaques à ces UV
- UV proche : 200-400 nm = niveau d'énergie élevé par rapport aux visibles = transitions d'énergie des molécules et absorption moléculaire des UV
Visible = entre 400 et 700nm = énergie + faible = absorption moins fréquente que l'UV
Transitions d'énergie des molécules
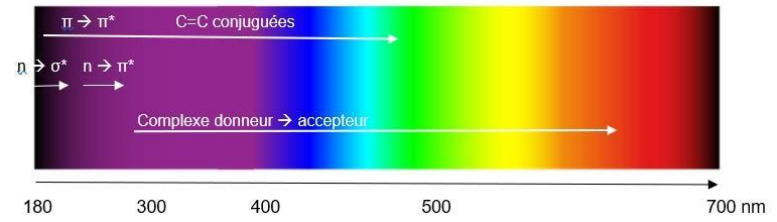
Transition σ -> σ*
-> transition d'énergie très élevée -> λ = 135nm
= pas absorbé en UV puisque inférieur à 200nm
Transition π -> π*
-> 2 orbitales π = faible recouvrement
- π -> π* = faible énergie
- λ + importante
-> doubles liaisons conjugués
- électrons localisés = échange de position des électrons = système de résonance
- signifie que les électrons sont plus faciles à exciter
- énergie de transition π -> π* + faible
ex : butadiène absorbe les UV à 217nm -> pour chaque molécule C=C additionnelle on a +25nm
217nm > 200nm donc on peut analyser cette molécule
β-carotène absorbe à 448nm = domaine du visible avec absorption du bleu-violet et apparaît orangé
448nm > 200nm donc on peut l'analyser
Transition n -> σ*
-> concerne les atomes O, N, S, Cl qui possèdent des doublets non liants (= n) couplé à une simple liaison
-> peuvent être portés à un état excité σ* donc orbitale moléculaire σ*
ex :
- eau : 180nm
- méthanol : 183nm
- éther : 190nm
- éthlamine : 210nm
Transition n -> π*
-> concerne les molécules possédant un atome O ou N (doublet n) relié à une double liaison
-> faible absorption à 270-300nm
Liaison de coordination donneur -> accepteur
-> donneur : doublet d'électrons (n) = O ou N
-> accepteur : sel métallique (orbitales d')
-> faible transition d'énergie = transition se fait par un rayonnement de faible énergie = domaine visible -> très forte absorption
Chromophores
= groupement chimique qui conduit à l'absorption
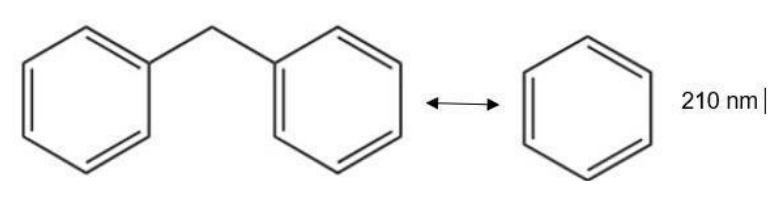
Chromophores isolés
-> séparés par 2 ou + liaisons σ = absorbent de façon indépendante
-> les 2 premiers sont reliés par 2 liaisons σ = les 2 cycles ne sont pas conjugués = molécule va absorber 210nm
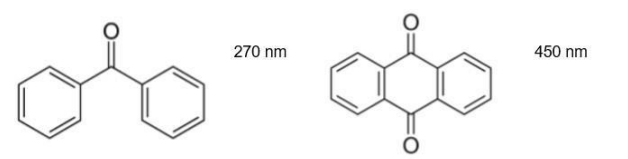
Chromophores conjugués
-> séparés par 1 seule liaison σ = augmentation de la longueur d'onde d'absorption et de l'intensité d'absorption
-> cétone = chromophore donc conjugaison des 3 chromophores = absorbe +
-> + le système conjugué s'étend + les effets sont importants
- 2ème molécule apparaît en rouge car absorbe le bleu à 450nm
Molécules analysées
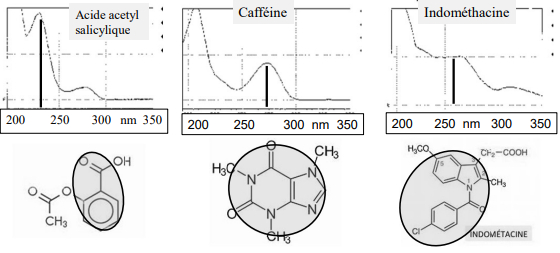
Les principes actifs
-> constitués d'un cycle avec un N ou un O = absorbent les UV
Protéines
-> il faut que la protéine possède au moins un de ces 3 acides aminés
- tryptophane : 290nm
- tyrosine : 289nm/4
- phénylalanine : 255nm/40
-> liaison peptidique : 190-220nm
-> caractéristique du pont disulfure = absorption à 250nm
- mais sont perturbés par les autres acides aminés qui vont absorber
Acides nucléiques
-> absorbe jusqu'à 250nm
-> les bases ont une transition π -> π*
-> contamination des acides nucléiques par des protéines
- rapport des absorbances 250nm/280nm
- permet de déterminer le niveau de pureté de A.N.
- si R < 1,8 -> protéines
- si R > 2 -> ARN
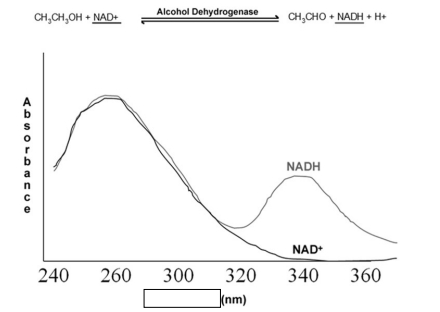
Enzymologie
-> NAD+ : absorbe à 250nm
-> NADH, H+ : absorbe à 250 + 330nm
= permet le suivi d'une transformation enzymatique
Chromophores de la vision
-> chromophore précurseur = le rétinol (vitamine A1) mais n'absorbe pas le domaine du visible (molécule liposoluble)
-> vit A1 oxydée en rétinal = augmente la longueur d'onde d'absorption
-> rétinal associé à l'opsine (protéine transmembranaire) = rhodopsine -> capable de mettre en place des liaisons de coordinations et produire la possibilité d'absorber le visible
-> différents types d'ospines
Chlorophyles
-> capture la lumière par N grâce à des liaisons donneurs -> accepteur Mg
-> atome d'azote qui capture la lumière, transmette l'énergie à d'autres protéines qui transforment l'énergie capturée
-> les feuilles qui jaunissent se traduisent par une perte d'activité
Analyse quantitative
= relie l'absorption de la lumière et la concentration des molécules en solutions
- extrêmement polyvalente
- calcul direct des concentrations
- = permet d'avoir un résultat direct
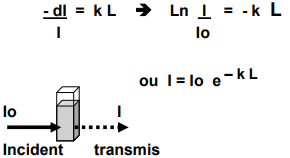
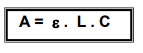
Loi de Beer et Lambert
Lambert -> dI/l = diminution relative de l'intensité d'un rayonnement est proportionnelle à l'épaisseur de matériaux absorbants traversée
- dI (diminution en pourcentage de l'intensité) dépend de l'épaisseur
Beer -> k = k'xC = pour des solutions faiblement concentrées (C)
<3
- A sans unité
- L : en cm
- C : en mol/L = ε : coefficient d'absorption molaire en cm1.(mol/L)-1
- C : en g/L = ε : coefficient d'absorption spécifique en cm-1.(g/L)-1
ε -> dépend de la longueur d'onde λ

à savoir faire
-> déduire la concentration d'après l'absorbance puisqu'on cherche S2 et 18,4mg = S1
-> A = εxLxC -> C = A/(εxL)
- C = 0,224/7800 = 2,87x10-5 mol/L
- C (en g/L-1) = MM x C = 520 x 2,87x10-5 = 0,0149 g/L soit 14,9 mg/L = solution S2
-> solution S1 est 10 fois + concentré = 14,9/100mL
-> or on a pesé 18,4mg pour 100mL, soit une pureté de 14,9/18,4 = 81%
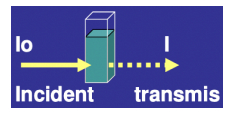
Transmission : lumière entrée/Iumière sortie = l/l0
Absorbance : log(1/T) = -log(T)
-> 90% absorbé = 10% transmis
-> T = I/I° = 0,1
A = log(1/T) = log-10) = 1
C = A/(εxL)
- = 1/(15000x0,03) = 2,2.10-3 mol/l
- = 2,2.10-3x500 = 1,1 g/L