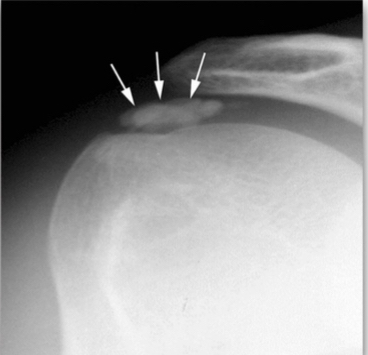
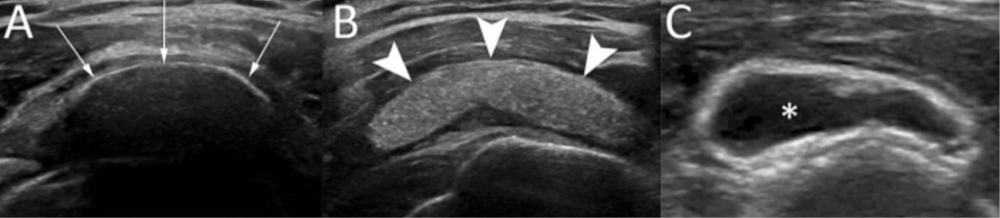
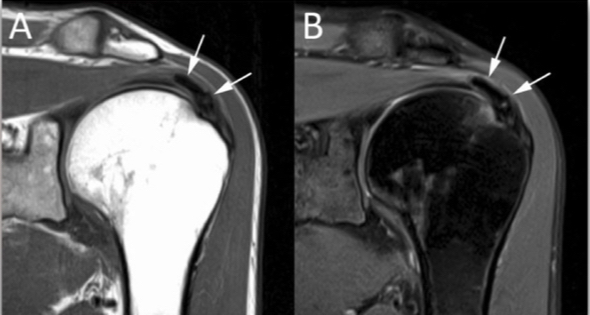
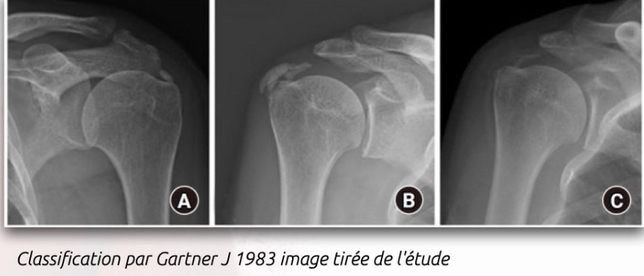
Classification de Gärtner (1983)
- Stade 1 : dense, contour bien défini, en formation.
- Stade 2 : dense, contour bien défini, translucide et homogène.
- Stade 3 : contour trouble, mal défini, translucide.
Classification de Molé (1993)
- Type A : contour bien défini, dense et homogène.
- Type B : contour bien défini, dense et polylobé.
- Type C : hétérogène, contours mal définis.
- Type D : dystrophie localisée au site d’insertion.
→ Louwerens et al. 2020 : la classification de Gärtner est plus fiable que celle de Molé.
Autres classifications :
Selon la durée
- Aiguë : < 2 semaines
- Subaiguë : 3 à 8 semaines
- Chronique : > 3 semaines
Selon le degré d’invasion
- Dépôts localisés ou diffus
- Les formes diffuses sont plus douloureuses et persistantes
- → Depalma et al. 1961 ; Louwerens et al. 2020 ; Gärtner 1983 ; Sansone et al. 2018.
Selon l’étiologie
- Type I (idiopathique) : sans maladie endocrinienne.
- Type II (secondaire) : associée à une affection endocrinienne (ex : diabète).
- Les formes secondaires répondent moins bien au traitement conservateur et nécessitent plus souvent une chirurgie.
Selon la taille des dépôts
- Petits : < 0,5 cm
- Moyens : 0,5 – 1,5 cm
- Gros : > 1,5 cm
Selon Neer (douleur + dépôts)
- Type 1 : irritation chimique due aux dépôts.
- Type 2 : pression tissulaire locale accrue.
- Type 3 : conflit sous-acromial avec bursite.
- Type 4 : raideur chronique gléno-humérale (épaule gelée).
→ Noël 1997 ; Wölk 1997 ; Ogon 2009 ; Cho 2010 ; Contreras 2013 ; Polastri 2020 ; Bechay 2020 ; Drummond 2021 ; Loew 2021.
- 50,4 % de bons/excellents résultats à 6 mois (n=125).
- 70 % à 49 mois (n=159).
- 27 % d’échec après 3 mois (kiné + AINS).
- Amélioration des scores Constant & UCLA à 16 mois.
- 28–40 % de taux d’échec selon les études.
- Disparition des symptômes à 18 mois dans la majorité des cas.
- 1re ligne de traitement recommandée (kiné, AINS, infiltration).
- 38,9 % ont finalement eu recours à la chirurgie après échec (4,4 mois).
- Complication possible : raideur secondaire de l’épaule (difficile à différencier d’une capsulite rétractile).
→ Noël 1997 ; Ogon 2009 ; Drummond 2021.
- Sexe féminin
- Calcification de type C (Molé)
- Calcification volumineuse
- Localisation antérieure à l’acromion
- Extension sous-acromiale
- Atteinte bilatérale
- Taille > 1 cm → corrélée à chirurgie.
- ROM et scores PROMS plus élevés → corrélés à chirurgie (patients actifs/exigeants).
Facteurs généraux
→ Louwerens et al. 2015 :
Sexe féminin (OR=1,5), âge 30–60 ans (OR=8,0), douleur (OR=7,1).
Facteurs endocriniens
→ Harvie 2007 ; Mavrikakis 1989 ; Su 2021 ; Lin 2020
- Désordres endocriniens et œstrogéniques favorisent la TC.
- Diabète : prévalence 31,8 % (x3).
- Risque accru de 27 % de TC à 8 ans post-diagnostic diabète.
- Hyperlipidémie : risque accru chez femmes taïwanaises.
Facteurs anatomiques et vasculaires
→ Codman 1934 ; Moseley & Goldie 1963 ; Uhthoff 1989 ; Rathbun 1970
- Zone critique du supra-épineux à 1,3 cm de l’insertion.
- Vascularisation : artères supra-scapulaire, circonflexes post/ant., thoraco-acromiale.
- Zone critique = faiblement vascularisée, surtout en adduction.
- Infra-épineux et sous-scapulaire aussi
Facteurs professionnels
→ Darrieutort 2019 ; Fernández-Cuadros 2015 ; Sansone 2018 ; Louwerens 2015
- Pas de lien avec travail manuel ni côté dominant.
- Risque accru avec mouvements répétitifs ou postures forcées.
- Risque plus élevé chez les travailleurs sédentaires.
- En RM + légère ABD → contraction accrue → ischémie locale.
Alimentation
→ Grases et al. 2015 :
- Faible taux de phytates urinaires → favorise les cristaux d’apatite.
- Phytates = inhibiteurs naturels présents dans céréales et légumes.
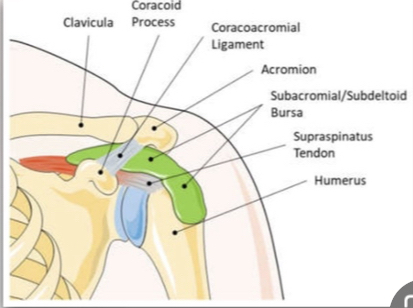
Image tirée de Schulz et al. 2022
1) Formation : transformation des ténocytes en chondrocytes → production de cristaux.
2) Résorption progressive : migration de cristaux vers la bourse → macrophages → inflammation modérée.
3) Migration active : pression → rupture tendineuse et bursite → inflammation intense (6h–72h).
1) Anamnèse
- Localisation, type de douleur, stade évolutif.
- Si douleur nocturne + irradiation + repos → irritabilité faible → mise en charge.
- Sinon → irritabilité élevée → priorité à l’anti-douleur.
- 🔴 Drapeaux rouges : tumeur, infection, fracture, neurologie, viscéral.
- 🟡 Drapeaux jaunes : anxiété, kinésiophobie, catastrophisme.
2) Observation et palpation
- Asymétries, cyphose, atrophie.
- Palpation préliminaire : chaleur, gonflement.
3) Examen clinique de base (ECB)
- ROM, douleur, qualité du mouvement, compensations.
- Test isométrique :
- Douleur sans faiblesse → tendinopathie.
- Douleur + faiblesse → rupture suspectée.
- Force de préhension corrélée à la force des rotateurs latéraux (Turabi 2022).
4) Palpation spécifique
- Supra/infra-épineux, sous-scapulaire, LHB, trapèze, rhomboïdes, petit pectoral…
McClure et al. 2013 Cools 2021
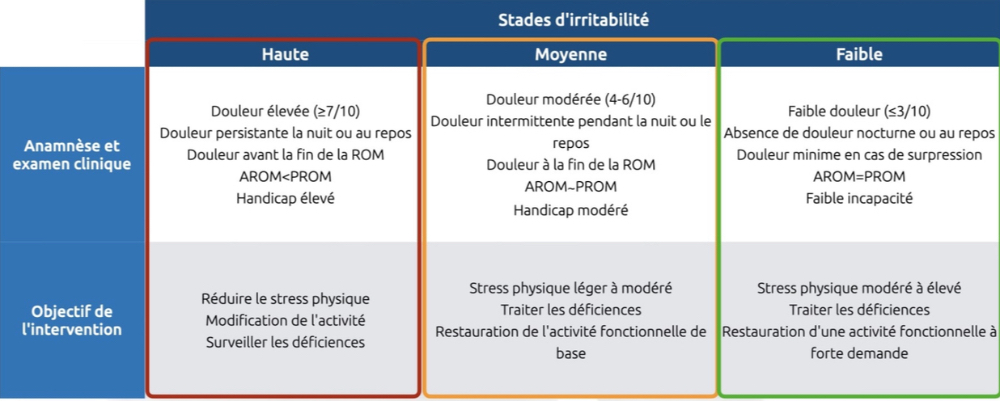
Définitions opérationnelles des trois stades de l'irritabilité tissulaire établies par consensus (McClure et al. 2015)