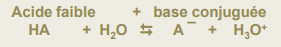Acides
-> composé (ion ou molécule) capable de libérer H+
-> espèce capable de capturer un doublet
Acides forts : libèrent totalement leurs protons dans l'eau
Acides
-> composé (ion ou molécule) capable de libérer H+
-> espèce capable de capturer un doublet
Acides forts : libèrent totalement leurs protons dans l'eau
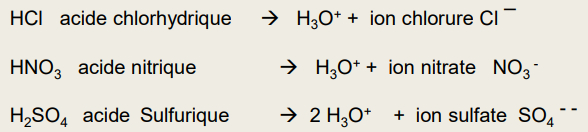
Acides faibles : libèrent partiellement son proton dans l'eau

si acide très faible : Ka diminue/pKa augmente
Bases
-> espèce capable de capturer H+
-> possède un doublet d'électrons (non liant) = capable de donner un doublet

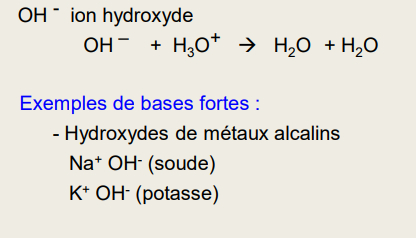
Base forte : capture tous les H+ dans l'eau
Bases faibles
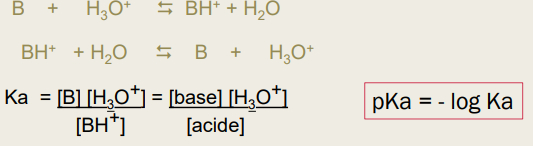
si le pKa est élevée : la base est + forte
Exemple :
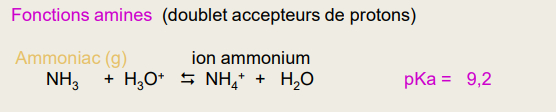
Couples acido-basiques

-> à tout acide correspond sa base conjuguée-> à toute base correspond son acide conjugué
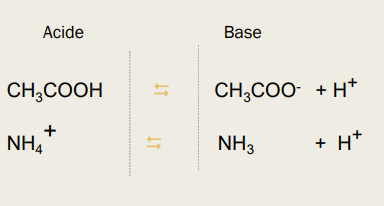
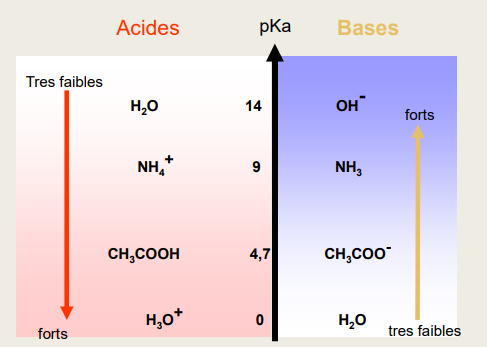
Classement des couples
-> plus le pKa est faible :
Amphotères (ampholytes)
-> espèce chimique qui se comporte à la fois comme un acide et comme une base
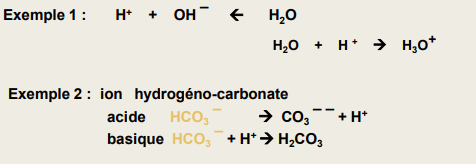
Réactions chimiques acide/base
-> quelque soit la force des acides et des bases
Réaction acide fort/base forte
= réaction totale

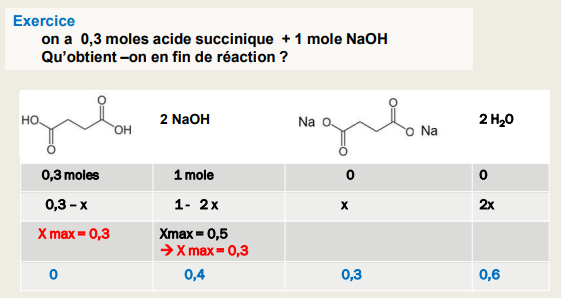
Poly acide : on tient compte du nombre de H+ libérés

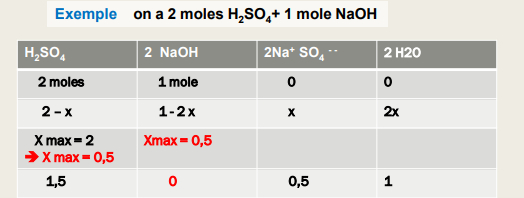
Réactions :
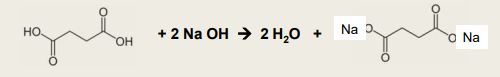
pH de solutions (potentiel hydrogène)
-> permet de quantifier la concentration en H3O+

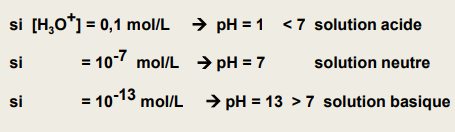
-> acide libèrent H+ = diminue le pH
-> bases capturent H+ = augment le pH
pH d'une solution avec un acide fort

pH d'une solution avec une base forte

-> si dilution au 1/10
pH d'une solution d'acide faible
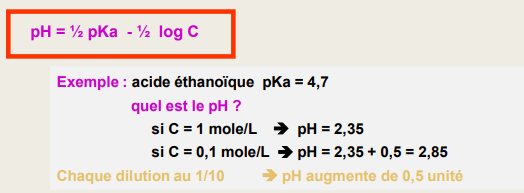
-> pour un di ou tri-acide faible :

pH d'une solution faible

-> pour un di base ou tri base faible :
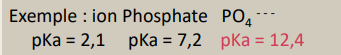
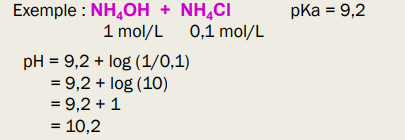
Solutions tampons
-> solution tampon contient HA et A- dans des concentrations équivalentes
-> empêche une variation de pH
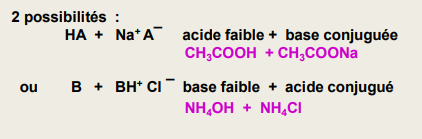
Intérêts :
-> pH est stable si :
-> régulation du pH de systèmes biologiques
pH d'une solution tampon
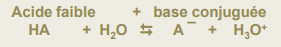

Acides
-> composé (ion ou molécule) capable de libérer H+
-> espèce capable de capturer un doublet
Acides forts : libèrent totalement leurs protons dans l'eau
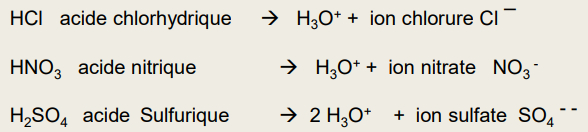
Acides faibles : libèrent partiellement son proton dans l'eau

si acide très faible : Ka diminue/pKa augmente
Bases
-> espèce capable de capturer H+
-> possède un doublet d'électrons (non liant) = capable de donner un doublet

Base forte : capture tous les H+ dans l'eau

Bases faibles
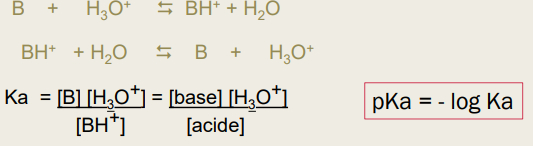
si le pKa est élevée : la base est + forte
Exemple :
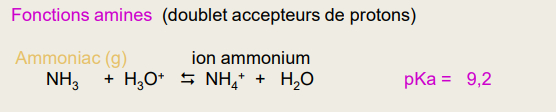
Couples acido-basiques

-> à tout acide correspond sa base conjuguée-> à toute base correspond son acide conjugué

Classement des couples
-> plus le pKa est faible :

Amphotères (ampholytes)
-> espèce chimique qui se comporte à la fois comme un acide et comme une base

Réactions chimiques acide/base
-> quelque soit la force des acides et des bases
Réaction acide fort/base forte
= réaction totale

Poly acide : on tient compte du nombre de H+ libérés


Réactions :
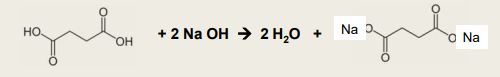

pH de solutions (potentiel hydrogène)
-> permet de quantifier la concentration en H3O+

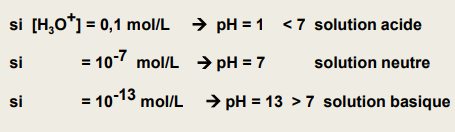
-> acide libèrent H+ = diminue le pH
-> bases capturent H+ = augment le pH
pH d'une solution avec un acide fort

pH d'une solution avec une base forte

-> si dilution au 1/10
pH d'une solution d'acide faible

-> pour un di ou tri-acide faible :

pH d'une solution faible

-> pour un di base ou tri base faible :
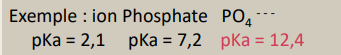
Solutions tampons
-> solution tampon contient HA et A- dans des concentrations équivalentes
-> empêche une variation de pH

Intérêts :
-> pH est stable si :
-> régulation du pH de systèmes biologiques
pH d'une solution tampon