-> atomes avec une tendance à gagner 2 électrons = électronégatifs ils vont donc capturer très facilement 2 électrons

Di-oxygène gazeux
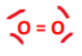
-> prép importante dans le milieu de la chimie
- distillation à partir de l'air libre = on liquéfie l'air ambiant puis on fait une distillation fractionnée = se vaporise à -183°C (liquide bleu pâle)
- électrolyse de l'eau alcalinisée = O2 très pur
-> gaz incolore et indolore
-> fait partie de l'air ambiant qui est oxydant = oxydations des molécules organiques ou inorganiques = comburant - il participe à des actions de combustion avec des combustibles
-> utilisé en oxygénothérapie : personne en insuffisance cardiaque ou respi
- stocké de façon pur dans des obus blancs
L'ozone
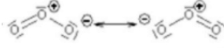
-> on ne peut pas l'équilibrer :
- O chargé négativement
- O chargé positivement
= délocalisation électronique = gaz non réactif + lourd que l'oxygène (1,5 fois plus dense) = ce qui explique certaines de ses propriétés
-> se liquéfie à -119°C (liquide bleu foncé), très instable qui libère facilement de l'oxygène
-> odeur très piquante - en grande quantité peut avoir une toxicité sur le système respiratoire
Ozone stratosphérique
Stratosphère : partie de l'atmosphère située à 25km d'altitude = largement au-dessus des montagnes les plus élevées
-> couche d'ozone qui nous protège des UV extrêmement réactifs, émis par le soleil, qui s'étale sur 20km
-> couche d'ozone :
- provient des UV et de la dissociation de dioxygène
- = UV réactifs parviennent à casser les liaisons covalentes entre 2 atomes d'oxygène et permettent de créer des radicaux libres d'oxygène = O.
- radicaux s'additionnent avec les molécules de dioxygènes pour former l'ozone dans la stratosphère
O. + O2 = O3
- dépend de la présence d'oxygène avant la stratosphère
- filtre 99% des rayonnements UV avec une longueur d'onde inférieur à 310nm
- sans couche d'ozone -> UV pourraient provoquer des dépressions génétiques
- menacé par différentes molécules telles que les ferons, les CFC qui produisent des radicaux chlorés = peuvent provoquer la dissociation de l'ozone
Ozone troposphérique
Troposphère : couche de l'atmosphère qui est présente à une altitude relativement faible = 0 à 7km
-> provient d'une part des UV et d'autre part du dioxyde d'azote qui est produit essentiellement par la circulation automobile = par les moteurs à explosion : UV + NO2
-> lorsqu'ils sont compressés dans le moteur à haute pression et haute température : dioxygène et diazote se combine pour former le NO2 = gaz d'échappement
- oxyde d'azote = instable -> se dissocie en monoxyde d'azote + O. qui va ensuite attaquer une molécule de dioxygène pour former l'ozone
= UV + NO2 -> NO + O.
O2 + O. -> O3
-> réaction favorisée par :
- canicule en zone urbaine
- absence de vent et de luminosité
- incendies de forêt
-> effet seuil sur la santé : dépend du temps d'exposition
- concentrations d'ozone de surface dépendent du temps d'exposition et qu'à 0,6ppm = impact sur le système respiratoire à partir de 8h d'exposition
-> préparation :
- avec une lampe à vapeur de mercure qui produit des décharges électriques et qui transforme le dioxygène en O. qui se combine ensuite au dioxygène pour produire l'ozone
lampe à vapeur de Hg -> 3 O2 + décharge électrique -> 2 O3 -> création d'O. = ozone
- électrolyse d'H2SO4 concentré :
- anode de Pt -> formation d'O3 à l'anode : 3H2O -> O3 + 6H+ + 6e-
- cathodes de graphite -> 6H+ 6e- + 3H2
- dans ce cas l'eau se décompose on ozone et en protons
-> propriétés : oxydant puissant et désinfectant
- peut libérer facilement de l'O2
-> application industrielle : purifier l'eau
- avantages par rapport au chlore (Cl) :
- pas de rémanence
- pas de formation d'organochlorés (potentiels cancérigènes)
- pas de mauvais goût
- élimine les composés organiques nocifs
- inconvénients :
- dangereux si dérèglement du dispositif
- ne détruit pas les micro-organismes
- coût important
- toxique pour l'Homme
= délaisser petit à petit pour le ttt par UV
-> toxicité : dépend du temps d'exposition
- à court terme (8h) à des pics d'O3
- très nocif pour les poumons, reins, cerveau, yeux
- 9 ppm = oedème pulmonaire - inflammation des poumons et des voies respiratoires MAIS pas d'effet sur le cancer du poumon
- 0,2 à 0,5 ppm = agit sur le système respiratoire, irritation oculaire et troubles rénaux et neurologies
- à long terme : diminution du développement pulmonaire chez l'enfant
réactions différentes selon les cas
-> exposition importante uniquement dans les sites de production MAIS n'est pas cancérigène
-> conseils :
- éviter les activités lorsque l'on a des alertes à l'ozone l'été
- pour les asthmatiques : rester à l'intérieur des bâtiments
Peroxyde d'hydrogène H2O2
-> dilué = composant qui ne présente aucun danger
-> pur = instable et libère spontanément du dioxygène = fait partie des comburants
-> en solution aqueuse = eau oxygénée

-> préparation :
- EO perd son activité
-> réaction lente :
- longue conservation de l'EO = forme pharmaceutique peut avoir une période d'utilisation sur plusieurs années
- favorisée par les impuretés des composés organiques, les poussières, les catalyseurs tels que MnO2 ou KmNO4 -> sans molécules extérieures : pas de réaction
- inhibée par les les agents stabilisants tels que PO42- = on ajoute des agents stabilisants qui empêchent la réaction spontanée pour stabiliser cette solution
-> titre :
= volume d'O2 dégagé par kg
- pure -> 330 volumes = très dangereux, explosive car libération importante de dioxygène
- 30% (30g d'H2O2 pour 100g de solution) -> 110 volumes = dangereuse car très concentrée
- 6% (m/m) -> 20 volumes = oxyde des pigments pour décolorer les cheveux
- 3% -> 11 volumes (11L de dioxygène libéré) = solution officinale
-> intérêts :
-oxydation en solution -> D.O. = -1
-la plupart du temps dioxygène se transforme et on obtient D.O. = -2
- antiseptique local :
- contact avec le sang = dismutation en O2 accélérée = permet de nettoyer la blessure
- à ne pas utiliser en trop grande quantité sinon cicatrisation altérée
- rôle oxydant sur les bactéries mais aussi sur le système cutané lésé
- efficace contre le tétanos
- ttt en dermato
- blanchiment
- ttt des eaux
- stériliser
- comburant
-> autres peroxydes :
- TATP = tri acétone tri peroxyde = solide explosif très instable car composante réductrice et oxydante au sein de la même molécule
- peroxyde de sodium Na2O2
Soufre et molécules soufrés
= molécules - électronégatives que l'oxygène -> groupement thiol (S-H ) = - polaire que les molécules avec un groupement O-H
- H2S = gaz et pas un un liquide car pas de liaison H
-> propriété de caténation :
- chaîne d'atomes : -S-S-S-S
- ponts disulfures : -S-S (protéines)
-> corps simple = solide -> molécule cyclique + forme cristalline
-> sous 3 formes sur terre :
- sulfates : gypse CaSO4
- sulfures : PbS, ZnS
- soufre natif : volcan
-> préparation : production de (S) à partir d'H2S = oxydation par O2 de H2S
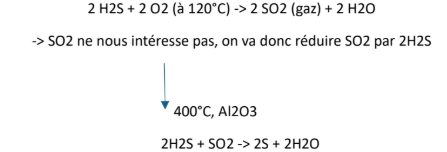
-> pourquoi H2S dans le pétrole et le gaz naturel
- provient des végétaux transformés au cours du temps = entraînent la production de pétrole -> dans ces végétaux se trouvent des protéines = des atomes de S qui se sont transformés en H2S
- pour le charbon : contient du soufre inorganique = en le brûlant on génère du SO2 qui est très nocif pour l'environnement
-> propriétés :
- oxydante
- en présence de dihydrogène on peut produite H2S = S + H2 -> H2S
- en présence de métal on peut produire des sulfures = métal sous forme de poudre par exemple ZnS : S (inorganique) + métal -> sulfure ZnS
- réducteur
- en présence de dioxygène le soufre brûle pour former SO2 = combustion avec libération d'O2 = on obtient un premier dérivé oxydé du soufre appelé anhydride sulfureux = S + O2 -> SO2 anhydride sulfureux + chaleur combustion du souffre en présence d'O2
-> application
- industrielle : préparation de l'acide sulfurique H2SO5 extrêmement important = ne coûte rien à produire
- agriculture : agit contre les champignons microscopique et moisissures = anticryptogamique
- thérapeutique : anticryptogamique = utilisés dans des pommades ou lotions dans le domaine dermato ou encore dans les eaux thermales pour limiter la prolifération bactérienne dans les affections ORL ou gynécologique (pas sous forme inorganique mais : S2 ou HS)
Sulfures
Sulfures d'hydrogène H2S
-> le + important à l'état naturel
-> produit de décomposition de la matière vivante = soufre présent dans les protéines se transforme en sulfure et est stocké dans les sous-sol
-> gaz toxique très caractéristique avec une odeur d'oeuf pourri
- gaz acide qui libère des protons qui vont réagir avec des solutions basiques
-> réagit avec des métaux pour former des sulfures métalliques comme l'argent : Ags sulfure d'argent
-> provient de la décomposition bactérienne de la matière = bactéries transforment la matière organique en sulfure
- produits alimentaires avec des protéines souffrées
- eaux usées qui proviennent des WC génèrent du H2S en se transformant dans les réseaux d'assainissement =
- gaz acide qui peut provoquer une corrosion des canalisations
- gaz lourd car masse molaire de 34 g/mol et peut donc s'accumuler dans les égoûts = mortels pour les égoutiers
-> peut être associer au pétrole dans les raffineries
-> pétrole + source chaude + gaz naturel + gaz volcanique = 2 origines : humaine et naturelle
-> origine : minerais sulfurés
-> oligoélément essentiel
-> conducteur

